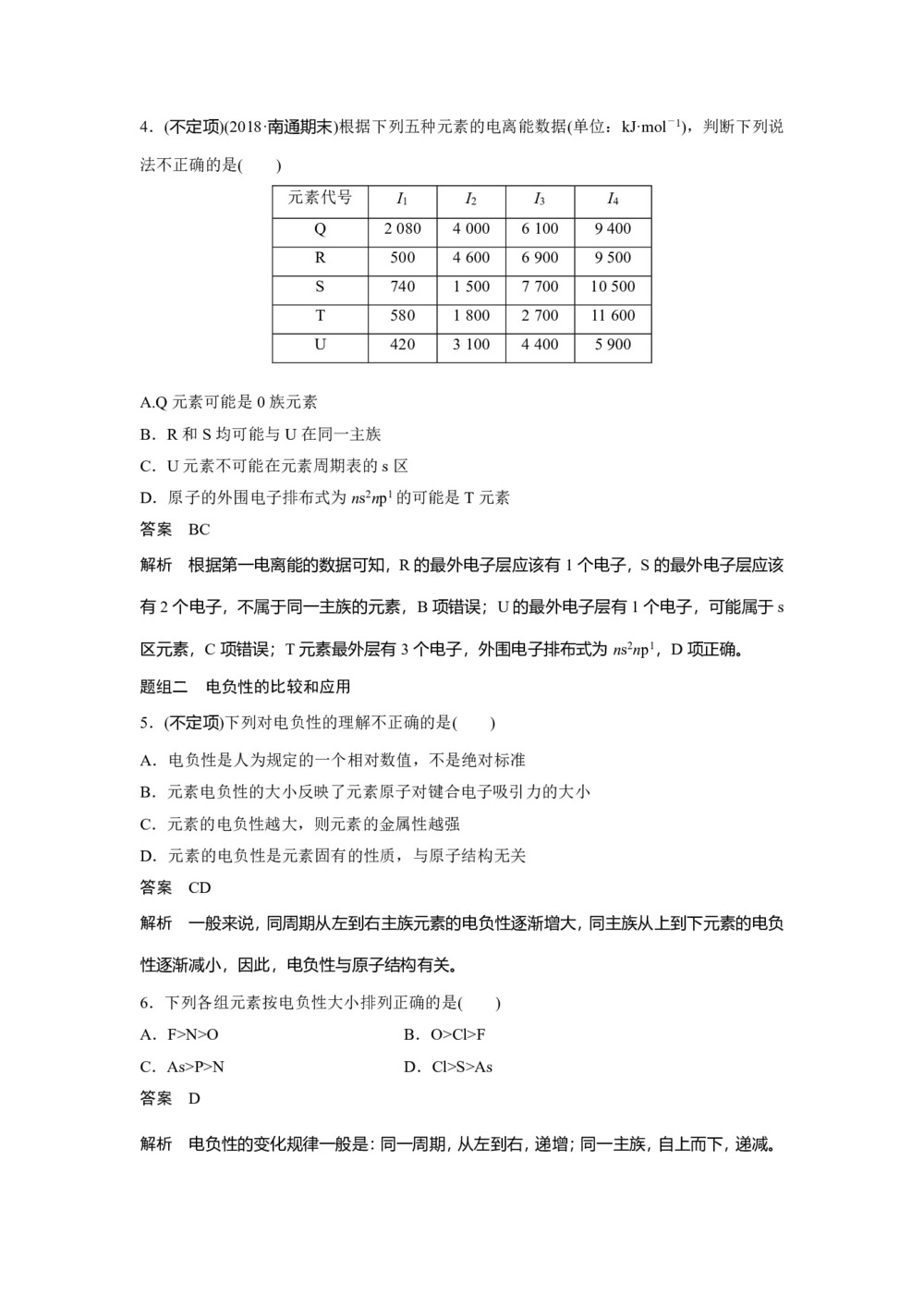
4.(不定项)(2018·南通期末)根据下列五种元素的电离能数据(单位:kJ·mol-1),判断下列说法不正确的是( )
元素代号 I1 I2 I3 I4 Q 2 080 4 000 6 100 9 400 R 500 4 600 6 900 9 500 S 740 1 500 7 700 10 500 T 580 1 800 2 700 11 600 U 420 3 100 4 400 5 900
A.Q元素可能是0族元素
B.R和S均可能与U在同一主族
C.U元素不可能在元素周期表的s区
D.原子的外围电子排布式为ns2np1的可能是T元素
答案 BC
解析 根据第一电离能的数据可知,R的最外电子层应该有1个电子,S的最外电子层应该有2个电子,不属于同一主族的元素,B项错误;U的最外电子层有1个电子,可能属于s区元素,C项错误;T元素最外层有3个电子,外围电子排布式为ns2np1,D项正确。
题组二 电负性的比较和应用
5.(不定项)下列对电负性的理解不正确的是( )
A.电负性是人为规定的一个相对数值,不是绝对标准
B.元素电负性的大小反映了元素原子对键合电子吸引力的大小
C.元素的电负性越大,则元素的金属性越强
D.元素的电负性是元素固有的性质,与原子结构无关
答案 CD
解析 一般来说,同周期从左到右主族元素的电负性逐渐增大,同主族从上到下元素的电负性逐渐减小,因此,电负性与原子结构有关。
6.下列各组元素按电负性大小排列正确的是( )
A.F>N>O B.O>Cl>F
C.As>P>N D.Cl>S>As
答案 D
解析 电负性的变化规律一般是:同一周期,从左到右,递增;同一主族,自上而下,递减。所以,F>O>N、F>O>Cl、N>P>As、Cl>S>As。
-
相关试卷下载
- 12019-2020学年苏教版选修3 专题2第二单元 元素性质的递变规律(第1课时) 作业
- 22018-2019学年苏教版选修3 专题2第二单元 元素性质的递变规律(第2课时) 作业
- 32019-2020学年苏教版选修3 专题2第二单元 元素性质的递变规律 作业
- 42019-2020学年苏教版选修3专题2第2单元元素性质的递变规律作业
- 52018-2019学年苏教版选修3 专题2第二单元 元素性质的递变规律 作业
- 62018-2019学年苏教版选修3专题2第2单元元素性质的递变规律第2课时作业
- 72018-2019学年苏教版选修3专题2第2单元元素性质的递变规律第1课时作业
- 82018-2019学年苏教版选修3专题2第2单元元素性质的递变规律第3课时作业
- 92018-2019学年苏教版选修3专题2第2单元元素性质的递变规律第2课时作业(1)