__________________写出上述反应的化学方程式_________________
________________________________________________。
12.已知有关物质的熔、沸点数据如下表所示:
MgO Al2O3 MgCl2 AlCl3 熔点/℃ 2852 2072 714 190(2. 5×105Pa) 沸点/℃ 3600 2980 1412 182.7 请参考上述数据填空和回答问题:
(1)工业上常用电解熔融.MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?答_________________________________________________________________
______________________________________________________________________。
(2)氯化铝是____________(填晶体类型),含有的化学键为____________________。
(3)在500 K和1.01×105Pa时,氯化铝的蒸气密度(换算为标准状况时)为11.92 g/I,试确定氯化铝在蒸气状态时的化学式为_______________。
(4)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是_______________
____________________________________________________________。
参考答案:
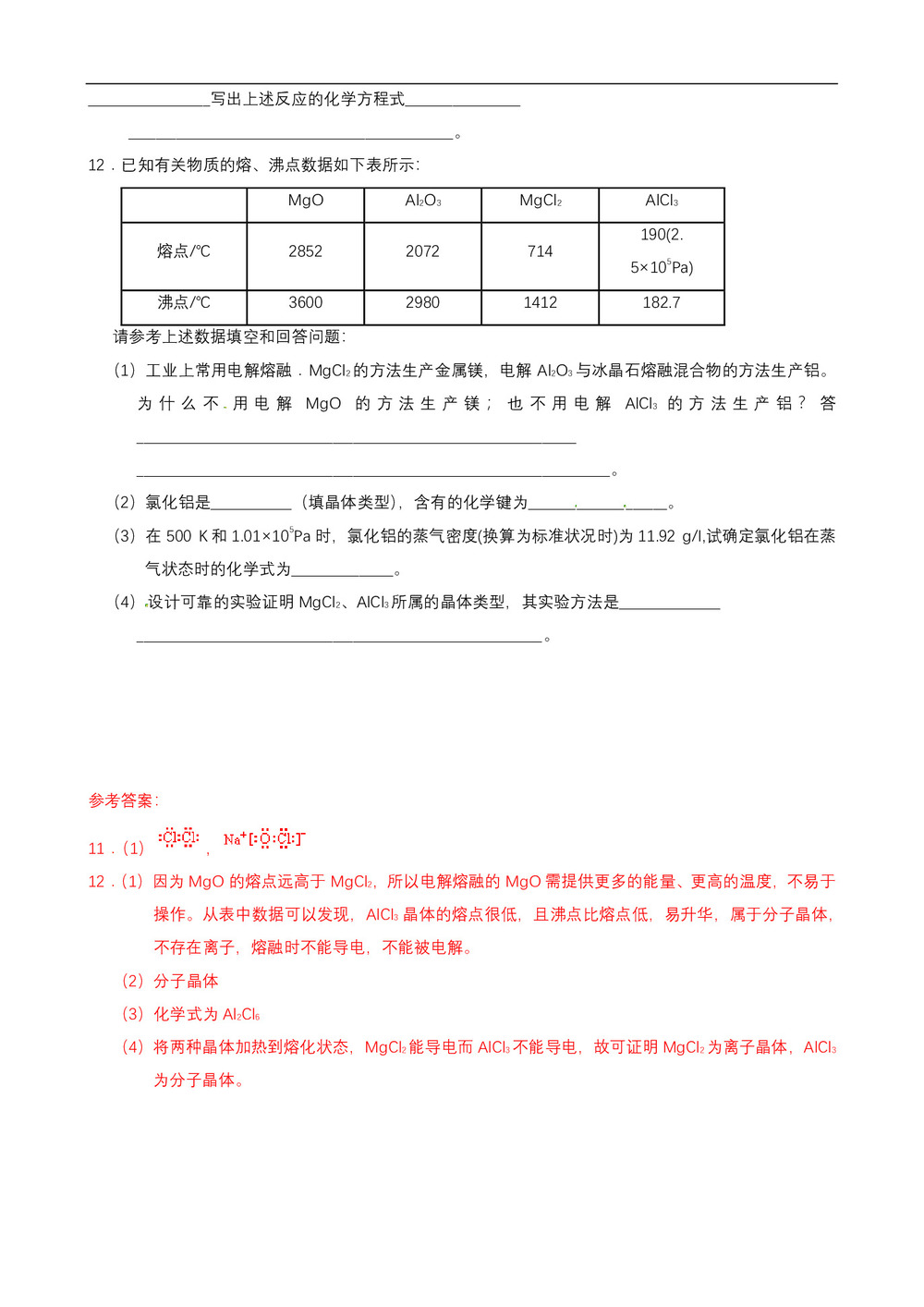
11.(1),
12.(1)因为MgO的熔点远高于MgCl2,所以电解熔融的MgO需提供更多的能量、更高的温度,不易于操作。从表中数据可以发现,AlCl3晶体的熔点很低,且沸点比熔点低,易升华,属于分子晶体,不存在离子,熔融时不能导电,不能被电解。
(2)分子晶体
(3)化学式为Al2Cl6
(4)将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故可证明MgCl2为离子晶体,AlCl3为分子晶体。
-
相关试卷下载
- 12019-2020学年苏教版必修2专题2第3单元化学能与电能的转化第1课时作业
- 22019-2020学年苏教版必修2专题2第3单元化学能与电能的转化第1课时作业(1)
- 32018-2019学年苏教版必修2专题2第3单元化学能与电能的转化第2课时作业
- 42018-2019学年苏教版必修2专题2第3单元化学能与电能的转化第1课时作业
- 52017-2018学年苏教版必修2 专题2第三单元 化学能与电能的转化(第3课时) 作业
- 62019-2020学年苏教版必修2专题2第3单元第2课时 电能转化为化学能作业
- 72018-2019学年苏教版必修2专题2第3单元化学能与电能的转化作业
- 82019-2020学年苏教版必修2专题2 第3单元 第2课时电能转化为化学能作业
- 92017-2018学年苏教版必修2 专题2第三单元 化学能与电能的转化(第2课时) 作业