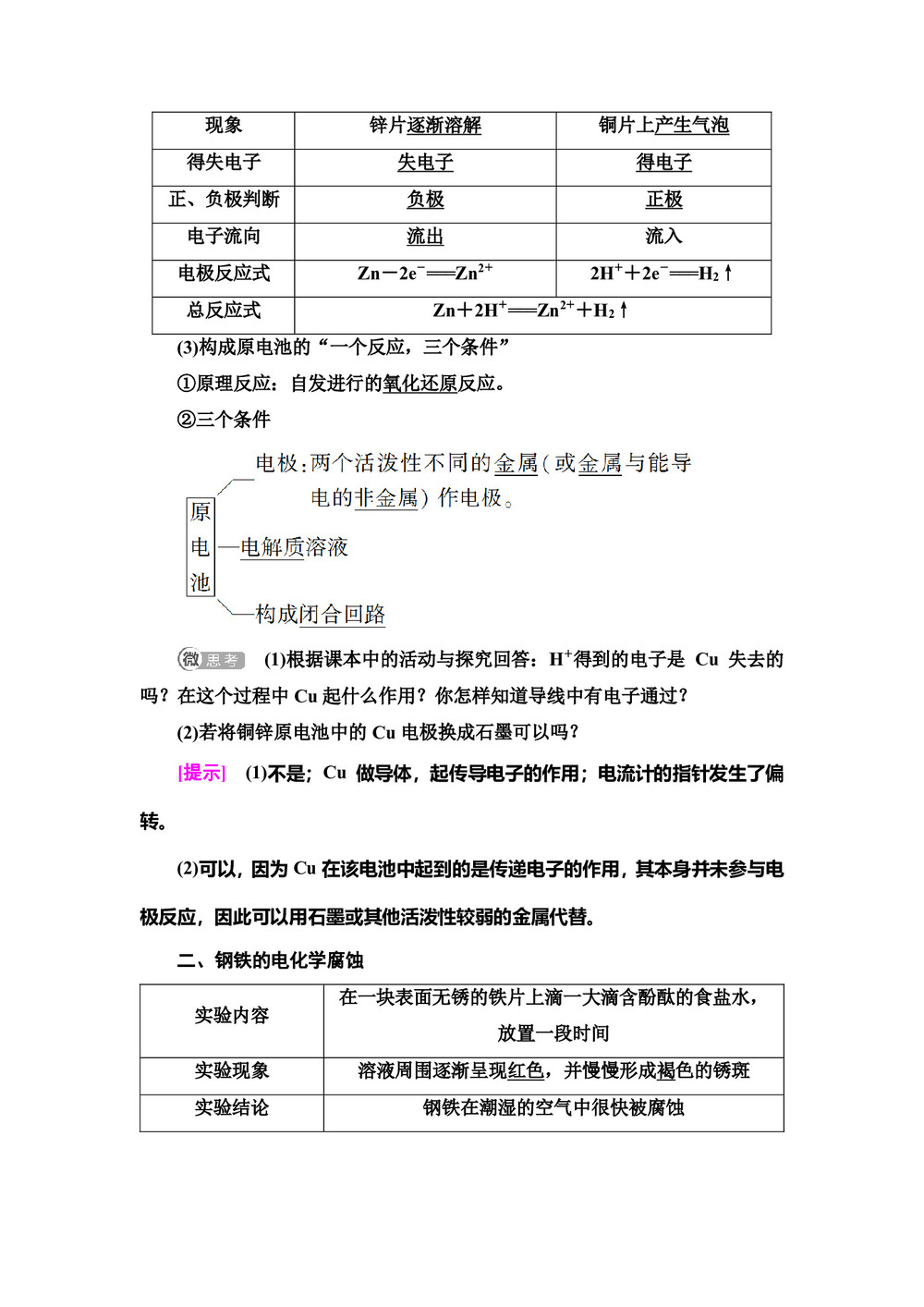
现象 锌片逐渐溶解 铜片上产生气泡 得失电子 失电子 得电子 正、负极判断 负极 正极 电子流向 流出 流入 电极反应式 Zn-2e-===Zn2+ 2H++2e-===H2↑ 总反应式 Zn+2H+===Zn2++H2↑ (3)构成原电池的"一个反应,三个条件"
①原理反应:自发进行的氧化还原反应。
②三个条件
(1)根据课本中的活动与探究回答:H+得到的电子是Cu失去的吗?在这个过程中Cu起什么作用?你怎样知道导线中有电子通过?
(2)若将铜锌原电池中的Cu电极换成石墨可以吗?
[提示] (1)不是;Cu做导体,起传导电子的作用;电流计的指针发生了偏转。
(2)可以,因为Cu在该电池中起到的是传递电子的作用,其本身并未参与电极反应,因此可以用石墨或其他活泼性较弱的金属代替。
二、钢铁的电化学腐蚀
实验内容 在一块表面无锈的铁片上滴一大滴含酚酞的食盐水,放置一段时间 实验现象 溶液周围逐渐呈现红色,并慢慢形成褐色的锈斑 实验结论 钢铁在潮湿的空气中很快被腐蚀
-
相关教案下载
- 12019-2020学年苏教版必修2专题2 第3单元 第2课时 电能转化为化学能学案
- 22017-2018学年苏教版必修2 专题2 第三单元 第一课时 化学能转化为电能 化学电源 学案
- 32018-2019学年化学同步苏教版必修2学案:专题2 第三单元 第一课时 化学能转化为电能 化学电源 Word版含解析
- 42019化学同步江苏专版必修2学案:专题2 第三单元 第一课时 化学能转化为电能 化学电源 Word版含解析
- 52017-2018学年苏教版必修2 专题2 第三单元 第二课时 电能转化为化学能 学案
- 62019-2020学年苏教版必修2 专题2第三单元 化学能与电能的转化(第3课时) 学案
- 72019-2020学年苏教版必修2 专题2第三单元 化学能与电能的转化(第1课时) 学案
- 82018-2019学年化学同步苏教版必修2学案:专题2 第三单元 第二课时 电能转化为化学能 Word版含解析
- 92019-2020学年苏教版必修2 专题2第三单元 化学能与电能的转化(第2课时) 学案